过去一个月,业界多款重磅产品的失意,引起不小讨论。
例如,一度被给予厚望的奥贝胆酸(OCA)在6月22日收到FDA的CRL,重新提交治疗NASH适应症注册申请之前,OCA至少需要达到REGENERATE研究的长期结果终点。再次受挫,令Intercept叫停所有与NASH相关的投资,重组业务以加强其对罕见和严重肝脏疾病的关注。无独有偶,4天后,由于中期临床研究中患者肝酶升高,辉瑞停止肥胖和糖尿病口服药物Lotiglipron的临床开发,转而押注其他候选产品,公司市值随之损失近100亿美元。新药研发从来不是“成功学”的宣讲,失败才是日常。好在总有后继者投身其中,让我们看到产业未来。
OCA折戟后,2023 EASL年会上披露数据的THR-β选择性激动剂Resmetirom,重燃了业界对攻克NASH的希望。
接受Resmetirom治疗所有关键亚组患者中,均观察到纤维化和NASH改善,且纤维化极端的恶化程度显著低于安慰剂组。Madrigal Pharmaceuticals已于6月30日向FDA滚动提交resmetirom治疗伴有肝纤维化NASH患者的NDA,预计7月全部提交完成。
创新对于获批的惊艳药物,同样是需要考虑的变量。礼来的斑秃新药Olumiant、艾伯维针对R/R DLBCL的CD3/CD20双抗Epkinly即是如此。6月,罗氏推出第二款CD3/CD20双抗Columvi,与艾伯维近身肉搏;辉瑞则以Litfulo,抢滩青少年斑秃患者市场。
此外,在罕见病领域,6月FDA也批准了相应的新药疗法。
Columvi:罗氏第2款CD3/CD20双抗,剑指百亿市场
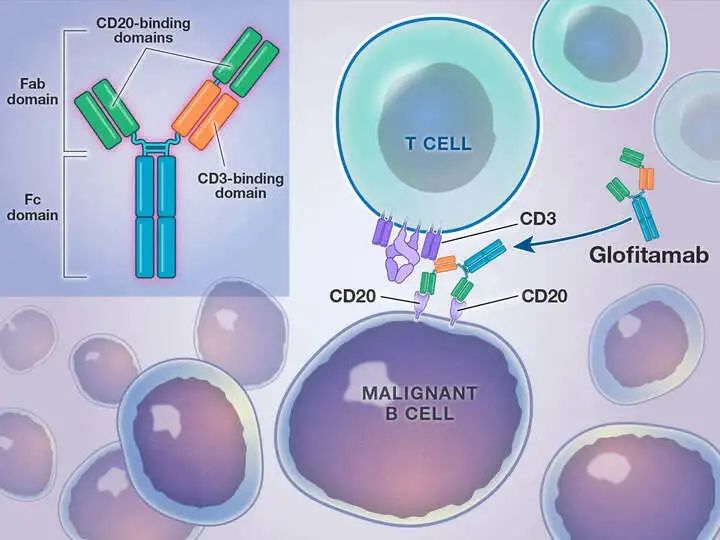
Lunsumio(Mosunetuzumab)之后,罗氏又一款CD3/CD20双抗Columvi(Glofitamab)获得FDA“盖章”认可,用于治疗已接受过至少二线系统治疗的R/R DLBCL或由滤泡性淋巴瘤引起的LBCL成人患者。该药已在今年3月先一步拿到加拿大的通行证。根据弗若斯特沙利文估计,截至2022年12月,在中国和全球分别有超过20万和近100万DLBCL存量患者,至2030年,预计患者数量将分别增长至30万、123万。Columvi和Lunsumio都能够增强T细胞对恶性B细胞的杀伤作用,但对比后者采用的1:1型的IgG1样双特异性抗体结构,Columvi是一款具有2:1结构(2个CD20结合域和1个CD3结合域)的IgG1样双特异性抗体。机制上,“2+1”形式的抗体具有有更强的杀伤效果,因此,Columvi作用强度更强,可以在安全耐受的前提条件下加强杀伤肿瘤细胞的能力,有效作用于侵袭性和难治淋巴瘤。Lunsumio的疗效则相对温和,细胞因子释放综合征(CRS)发生概率相对较低,更适用于治疗滤泡性淋巴瘤(FL)等惰性淋巴瘤。此次批准主要基于NP30179研究的I/II期数据:43.0%的患者达到完全缓解,56.0%的患者实现客观缓解。应答者的中位随访估计为11.6个月,中位缓解持续时间为18.4个月。
Columvi的作用机制(图源:The New England Journal of Medicine)
值得一提的是,5月,艾伯维和Genmab的CD20xCD3双抗Epkinly(Epcoritamab)获得FDA批准上市,成为美国首个用于治疗R/R DLBCL的双抗药物。而FDA此次对Columvi的批准,甚至比之前已经缩短的优先审查时间还提前了两周。不难想象,Columvi和Epkinly将上演激烈的正面对抗。在治疗时间上,Columvi稍胜一筹,其缓解持续时间较长,可在固定时间内提供,Epkinly则是在疾病进展前给药;但作为一款皮下注射制剂,Epkinly在临床应用上更具便利优势,Columvi是静脉输注药物,罗氏仍在研究这种药物的皮下注射配方。Columvi在中国的开发正同步进行。CDE官网显示,1月6日,Columvi在华申报上市并被纳入拟优先审评名单,拟用于治疗既往接受过至少两线系统性治疗的R/R DLBCL和原发性纵隔LBCL成人患者。
Litfulo:80%头发再生,首款用于青少年患者的斑秃新药
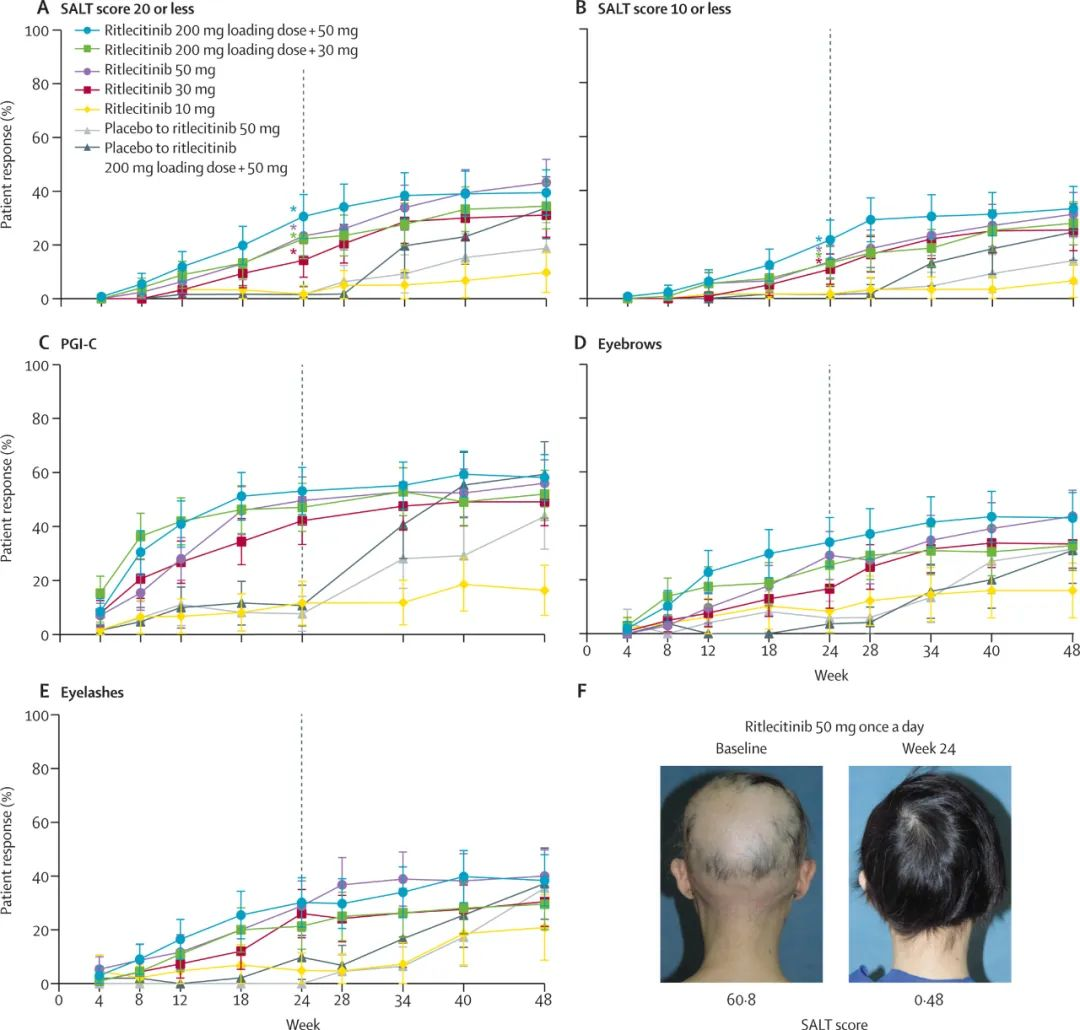
斑秃是第二大常见脱发类型,仅次于雄激素脱发(脂溢性脱发),临床表现为毛发斑片状脱落。全球约有1.47亿斑秃患者,在中国则约有400万患者群体。分析机构估计,到2026年,全球脱发市场规模将增长至134.4亿美元。在首款口服斑秃疗法Olumiant获得FDA批准后的一年,辉瑞也迈入了斑秃市场。6月24日,辉瑞宣布FDA已批准其双激酶抑制剂Litfulo(ritlecitinib)上市,治疗12岁以上严重斑秃患者。这是FDA首次批准用于重度斑秃青少年(12岁以上)的治疗药物,也是继礼来和Incyte联合开发的Olumiant之后,第二款获得批准的全身治疗药物。作为一天一次的新型口服共价双激酶抑制剂,Litfulo对JAK3激酶以及在TEC家族中的酪氨酸激酶具高度选择性。该药可借由抑制造成脱发的免疫细胞内信息通路,来达到治疗斑秃的效果。此次批准基于临床IIb/III期试验,研究人员招募了718名通过脱发严重程度工具(SALT)测量头皮脱发率达到或超过50%的患者。结果显示,23%接受50mgLitfulo治疗的患者在6个月后头皮毛发覆盖达80%或以上(SALT≤20),而此数值在安慰剂组仅为1.6%。分析显示,青少年(12-17岁)和成人(18岁及以上)使用Litfulo的疗效和安全性一致。安全性方面,至少4%使用Litfulo的患者所报告最常见不良事件(AE)包括头痛(10.8%)、腹泻(10%)、痤疮(6.2%)、皮疹(5.4%)和荨麻疹(4.6%)。今年4月,ALLEGRO试验的完整结果在《柳叶刀》上发表。同为JAK抑制剂,辉瑞的Litfulo上市比礼来的Olumiant触及更广泛的患者群体,这或许将成为其主要竞争优势。不过,与其他JAK抑制剂一样,Litfulo的标签上还附有针对严重感染、恶性肿瘤、主要不良心血管事件(MACE)和血栓形成的安全性警告。定价问题上,BMO Capital分析师Keith Tapper在Olumiant获批前表示,辉瑞的产品定价可能与Olumiant相比更具竞争力。辉瑞的发言人称,公司将以49000美元的定价出售Litfulo,供全年使用。Olumiant 30天2mg片剂的标价为2622美元,4mg片剂的标价为5244美元。去年,该药全球收入8.31亿美元,比前一年大幅下降26%。
Rystiggo:FcRn单抗,罕见肌肉萎缩症的双用药
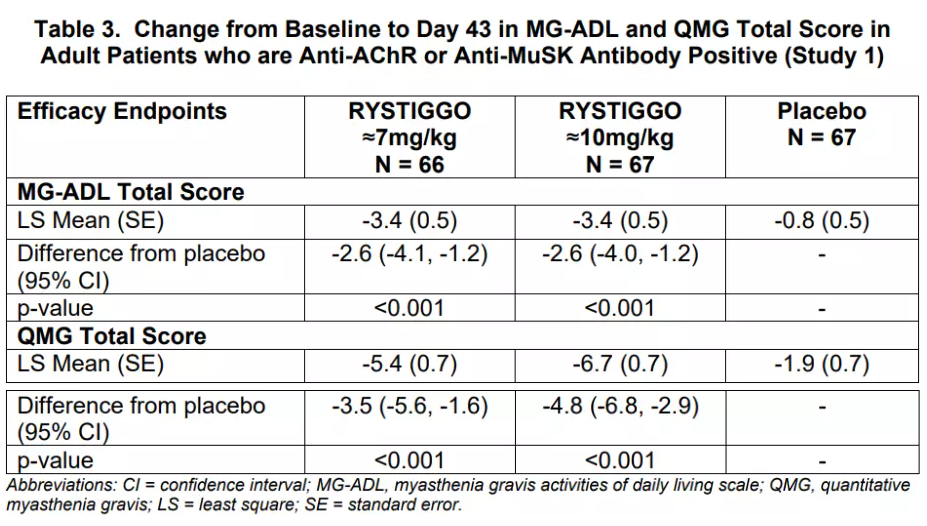
6月26日,FDA批准UCB旗下药物Rystiggo(rozanolixizumab)上市,用于治疗抗乙酰胆碱受体(AChR)或抗肌肉特异性酪氨酸激酶(MuSK)抗体阳性的成人全身型重症肌无力(gMG)。这是FDA批准的唯一一种治疗抗achr和抗musk抗体阳性gMG成人的新药。Rystiggo是一种皮下注射的人源化单克隆抗体,以高亲和力特异性结合人类新生儿Fc受体(FcRn),旨在阻断FcRn和免疫球蛋白G(IgG)的相互作用,加速抗体的分解代谢并降低致病性IgG自身抗体的浓度。该产品分别于2019与2020年自FDA与欧盟获得孤儿药资格,用以治疗MG。此次批准基于关键性III期临床试验MycarinG的结果。在该研究中,Rystiggo在AChR MuSK抗体阳性MG患者的MG特异性结局中,显示出显著统计学和临床意义上的改善。接受Rystiggo治疗的患者组与安慰剂组患者相比,重症肌无力日常活动度(MG-ADL)评分在43天后获得显著改善,Rystiggo组MG-ADL评分降低3.4分,安慰剂组降低0.8分。MG是一种获得性自身免疫性疾病,由神经肌肉传递障碍引起的骨路肌收缩无力为主要症状,也就是附着在骨路上、能够做出动作的肌肉逐渐失去力量。患者自身的致病性IgG抗体会破坏神经和肌肉之间的突触传递,引起虚弱和可能危及生命的肌无力。这是一种罕见的慢性自身免疫性疾病,全世界约有70万名患者。UCB还向FDA递交了Zilucoplan(一种皮下自我给药补体C5抑制剂)的上市申请,这也是一款用于治疗AChR抗体阳性成人gMG。此前,全球仅有Argenx开发的FcRn单抗Efgartigimod获得FDA批准,用于治疗gMG。今年6月20日,这款药物的皮下注射剂已获批。强生管线中的一款FcRn单抗nipocalimab紧随其后,已处于临床III期阶段。该产品在适应症方面具有差异化,强生正在开发nipocalimab用于治疗温抗体型自身免疫溶血性贫血、巨细胞动脉炎、特发性炎性肌病、胎儿和新生儿溶血性疾病等适应症。除了MG之外,UCB还在探索Rystiggo在其他领域的可能性。Insight数据库显示,Rystiggo在全球已开展针对多种自身免疫性疾病的18项临床试验,包括原发性免疫性血小板减少症(ITP)、抗髓鞘少突胶质细胞糖蛋白免疫球蛋白G抗体(MOG-IgG)相关疾病(MOGAD)、自身免疫性脑炎(AIE),其中一些目前已处于III期临床阶段。
Ngenla:每周皮下注射一次,一年可长高10厘米
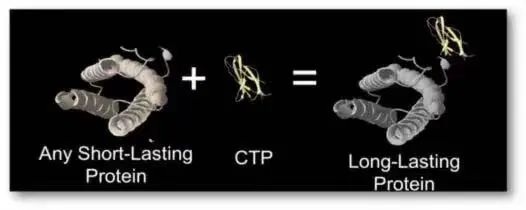
FDA官网显示,6月27日,辉瑞和OPKO Health合作的长效人类生长激素类似物Ngenla(somatrogon)获批上市,该药每周皮下注射一次,用于治疗三岁以上儿童患者因内源性生长激素分泌不足而出现生长衰竭。儿童生长激素缺乏症(GHD)因为脑下垂体不能产生足够的生长激素引起。约4000至10000名儿童中就有一人受到影响。如果不进行治疗,儿童的生长将持续减弱,成年后身高很短。几十年来,儿童GHD的护理标准一直是每天皮下注射一次人类生长激素(hGH),以改善生长和代谢。对于护理者和患者来说,每日注射的治疗负担很高,这会导致依从性差,降低整体治疗结果。在这方面,Somatrogon有一定优势。与生长激素Genotropin相比,Somatrogon在体内的作用持续时间更长且无需每天注射。这一批准得到一项III期临床试验结果的支持。结果显示,与每日注射一次的生长激素相比,Somatrogon达到非劣效性标准。在接受治疗12个月时,Somatrogon组的年身高增长速度为10.12厘米/年,活性对照组为9.78厘米/年。
OPKO专有的C末端肽段(CTP)长效技术能显著延长蛋白的半衰期(图源:药明康德)
2014年,辉瑞和OPKO就Somatrogon治疗GHD的开发和商业化达成了一项全球协议。根据该协议,OPKO负责开展临床项目,辉瑞负责注册Somatrogon并将其商业化用于GHD。Somatrogon已在在加拿大、澳大利亚、日本和欧盟成员国等40多个市场被批准用于治疗儿童GHD,预计将于今年8月登录美国市场。
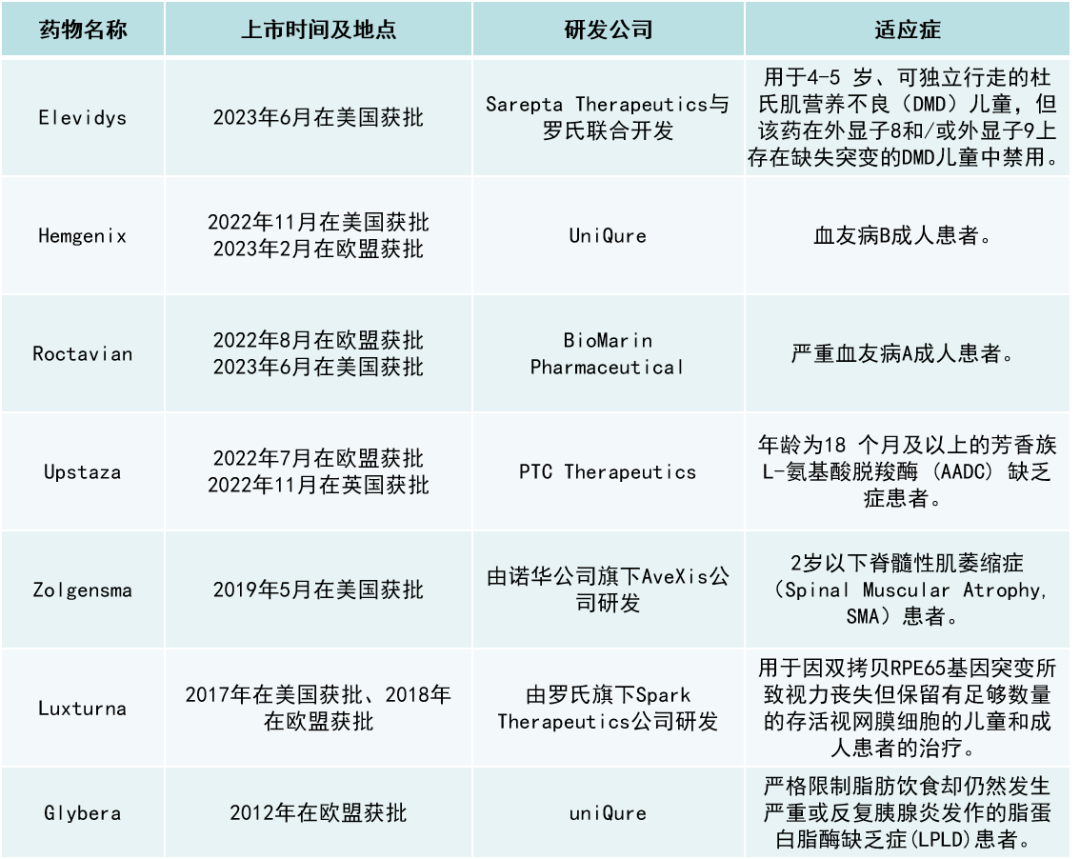
Roctavian:首个治疗严重血友病A患者的基因疗法
BioMarin于6月29日宣布,FDA批准其基因疗法Roctavian(valoctocogene roxaparvovec)上市,治疗成人严重A型血友病(先天性凝血因子VIII缺乏症,FVIII活性<1 IU/dL)。Roctavian是首个获得FDA批准治疗严重血友病A患者的基因疗法。血友病A是由于缺乏凝血因子VIII而导致的一种罕见遗传性出血性疾病,以反复出血及其相关并发症为主要临床表现。目前,血友病A的主要治疗手段是定期输注凝血因子VIII。血友病A比血友病B更普遍,每10000人中约有1人患病。BioMarin估计,美国约有6500名成人患重度血友病A。Roctavian使用AAV5病毒载体递送表达凝血因子VIII。它的优势在于患者可能只需要接受一次治疗,肝细胞就可以持续表达凝血因子VIII,从而不再需要长期接受预防性凝血因子注射。目前,超70%基因递送药物均采用AAV载体递送。而随着AAV递送系统不断成熟,基于AAV的基因治疗药物有了重大突破。截至目前,全球已获批上市的AAV基因疗法共有7款。
图源:细胞与基因治疗领域
FDA对Roctavian的批准是基于全球III期GENEr8-1研究的数据,这是血友病基因治疗中最大的III期试验之一。112例患者在接受Roctavian治疗前,接受FVIII预防性治疗至少6个月,并在期间内前瞻性地收集患者的基线年化出血率(ABR)数据,其余22名患者的基线ABR数据则通过回顾性方式收集。112例接受该基因疗法的患者在中位3年随访期间,平均ABR下降了52%。大多数受试者持续对治疗有应答,直至第3年及以后,没有进行常规的预防性治疗。此外,与入组前一年的数据相比,单次输注Roctavian后,受试者的ABR显著降低,重组凝血因子VIII蛋白制剂使用频率降低,或者体内血液中VIII活性显著增加。在接受治疗4周后,受试者的年VIII使用率和需要接受治疗的ABR分别降低了99%和84%,统计学差异显著且安全性良好。早在2019年底,BioMarin就向FDA提交了关于Roctavian的BLA,一项大型临床试验的结果表明,该疗法大大降低了严重A型血友病患者的出血率和对凝血因子VIII输注的需求。可惜当时FDA还是拒绝了BioMarin的申请,并要求BioMarin收集该试验中每个参与者至少两年的数据。BioMarin收集了这些数据后,于2022年9月下旬向FDA重新提交申请。有分析人士认为,Roctavian可能会成为BioMarin营收的重要拐点。BioMarin的首席商务官Jeff Ajer表示,Roctavian在美国的定价为290万美元,高于该疗法在欧洲的定价(约为150万欧元)。SVB证券公司的Joseph Schwartz预测,Roctavian年销售额峰值约为22亿美元。但Roctavian也面临着一个很大的挑战。与FDA目前批准的十多种基因疗法不同,Roctavian针对的适应症已经有很多其他的治疗选择。例如,罗氏公的抗体药物Hemlibra就销售火爆。SVB Securities分析师表示,Roctavian最初的销售增长将是缓慢的。“然而我们相信,BioMarin的毅力、与医学界的长期联系,以及长期的数据,最终将有助于产品的推出。”